Để có thể làm nhanh các dạng bài toán liên quan đến nhận biết các ion trong dung dịch. Học sinh cần nắm được các kiến thức sau đây
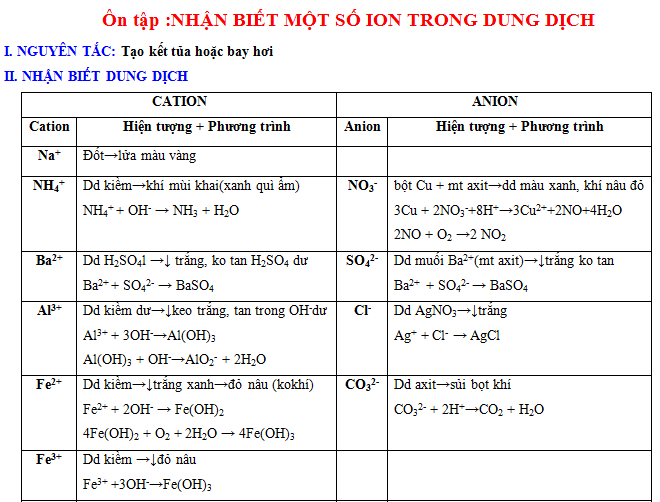
NGUYÊN TẮC: Tạo kết tủa hoặc bay hơi
NHẬN BIẾT DUNG DỊCH
| CATION | ANION | ||
| Cation | Hiện tượng + Phương trình | Anion | Hiện tượng + Phương trình |
| Na+ | Đốt→lửa màu vàng | ||
| NH4+ | Dd kiềm→khí mùi khai(xanh quì ẩm) NH4+ + OH– → NH3 + H2O | NO3– | bột Cu + mt axit→dd màu xanh, khí nâu đỏ 3Cu + 2NO3–+8H+→3Cu2++2NO+4H2O 2NO + O2 →2 NO2 |
| Ba2+ | Dd H2SO4l →↓ trắng, ko tan H2SO4 dư Ba2+ + SO42- → BaSO4 | SO42- | Dd muối Ba2+(mt axit)→↓trắng ko tan Ba2+ + SO42- → BaSO4 |
| Al3+ | Dd kiềm dư→↓keo trắng, tan trong OH–dư Al3+ + 3OH–→Al(OH)3 Al(OH)3 + OH–→AlO2– + 2H2O | Cl– | Dd AgNO3→↓trắng Ag+ + Cl– → AgCl |
| Fe2+ | Dd kiềm→↓trắng xanh→đỏ nâu (kokhí) Fe2+ + 2OH– → Fe(OH)2 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 | CO32- | Dd axit→sủi bọt khí CO32- + 2H+→CO2 + H2O |
| Fe3+ | Dd kiềm →↓đỏ nâu Fe3+ +3OH–→Fe(OH)3 | ||
| Cu2+ | Dd NH3→↓Xanh, tạo phức tan màu xanh Cu2+ + 2OH– →Cu(OH)2 Cu(OH)2 + 4NH3 → Cu[(NH3)4](OH)2 | ||
III. NHẬN BIẾT CHẤT KHÍ
| Chất | Hiện tượng – phương trình |
| CO2 | Dd Ca(OH)2 hoặc Ba(OH)2 dư→kết tủa trắng CO2 + Ca(OH)2→CaCO3 + H2O |
| SO2 | Dd Br2→ mất màu nâu đỏ dd Br2 ( SO2 cũng tạo kết tủa trắng +dd Ca(OH)2 hoặc Ba(OH)2 dư) SO2 + Br2 + 2H2O → 2HBr + H2SO4 |
| H2S | Dd muối Cu2+ hoặc Pb2+→kết tủa đen H2S + Cu2+ → CuS + 2H+ H2S + Pb2+ → PbS + 2H+ |
| NH3 | Quỳ tím ẩm→hóa xanh |